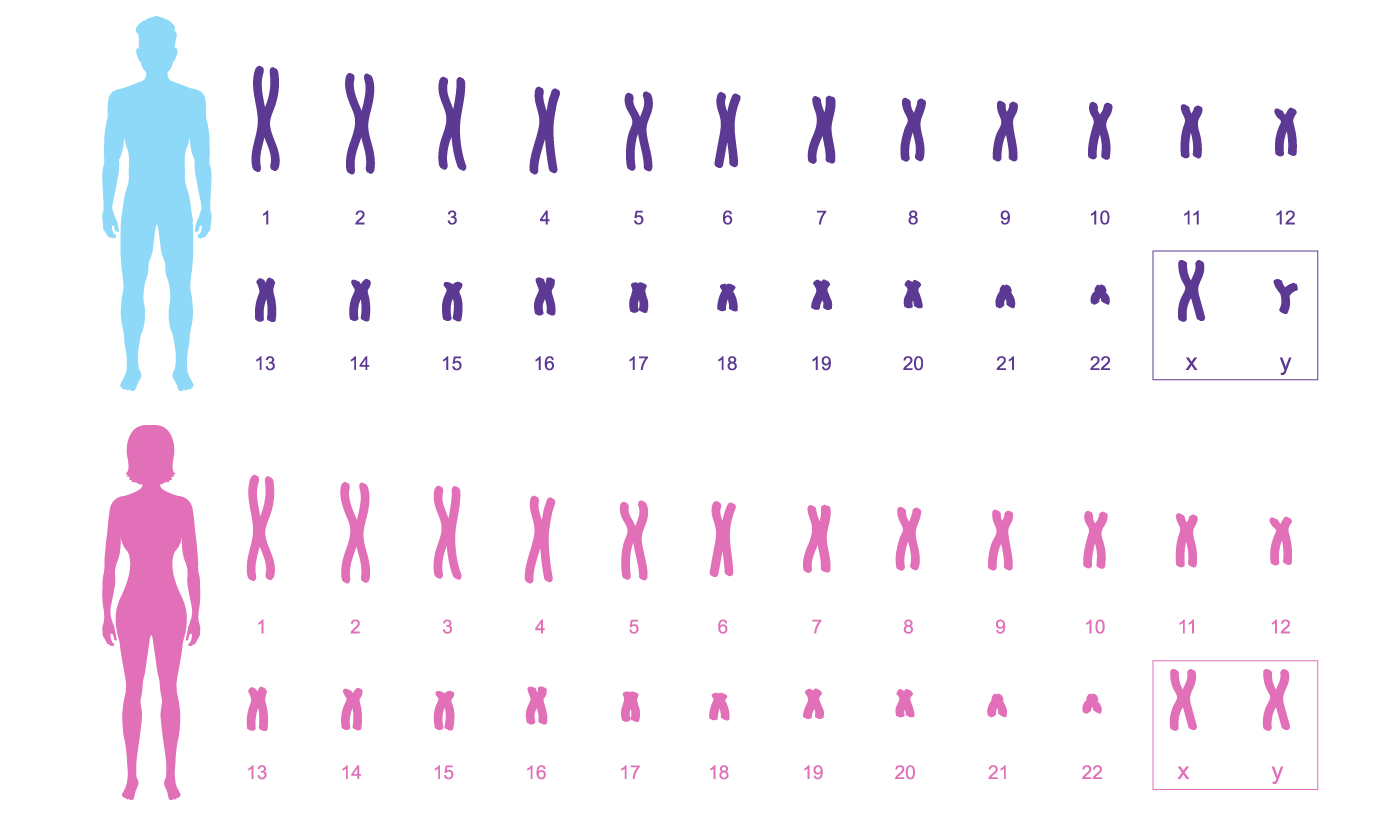TESTS GÉNÉTIQUES
Tests Génétiques
TESTS GÉNÉTIQUES
Tests Génétiques

Le diagnostic génétique préimplantatoire (DPI) est une technique scientifique très avancée pour tester, diagnostiquer et sélectionner des embryons exempts d’anomalies génétiques ou chromosomiques avant leur transfert dans l’utérus. Cela réduit le risque de transmission de maladies génétiques dévastatrices, réduit la probabilité de fausses couches récurrentes et améliore les chances de succès de la grossesse.
Un embryon normal contient 46 chromosomes qui sont hérités des deux parents pendant le processus de fécondation. Le spermatozoïde contribue par 23 chromosomes et l’ovocyte par les 23 autres. Quand un embryon est détecté pour avoir une quantité anormale de chromosomes (trop ou trop peu), il est appelé aneuploïde. La plupart des embryons ayant un nombre incorrect de chromosomes font une fausse couche ou ne parviennent pas à implanter au cours du premier trimestre de la grossesse, ce qui est connu pour causer des grossesses manquées et des malformations congénitales.
Le risque de trouver des anomalies chromosomiques augmente avec l’âge de la femme. À 40 ans, 58 % des chromosomes d’une femme sont chromosomiquement anormaux. C’est pourquoi les femmes âgées ont un tel risque de fausse couche ou de naissance avec un trouble chromosomique comme le syndrome de Down.
Les tests génétiques aident à prévenir ces résultats en identifiant les embryons touchés au cours de leur développement en laboratoire. Ils permettent de déterminer si un embryon a une quantité normale de chromosomes avant d’être transféré dans l’utérus d’une femme pendant un cycle de FIV. les couples peuvent maintenant augmenter leurs chances d’implantation, réduire leur risque de fausse couche et diminuer leur risque d’avoir un enfant atteint d’une maladie génétique. Les affections les plus courantes causées par des anomalies chromosomiques comprennent le syndrome de Down, le syndrome de Klinefelter et le syndrome de Turner.
Au Centre Fertinord, nous sommes fiers d’offrir les dernières techniques pour donner à nos couples les meilleurs soins et maximiser leurs chances d'avoir un enfant sain.
Les tests génétiques peuvent être effectués à deux étapes cruciales du cheminement d’un couple vers la parentalité : soit chez le couple avant la phase de grossesse soit sur les embryons avant la phase de transfert d’un cycle de FIV.
Ce simple test salivaire est effectué avant la grossesse. Il permet de dépister jusqu’à 410 maladies génétiques potentielles et peut aider à identifier les couples qui présentent un risque accru de troubles génétiques familiaux ou liés à l’âge et de malformations congénitales. Cependant, aucun test ne peut à lui seul prédire avec exactitude le risque de toutes les anomalies chez un enfant, et de nombreuses anomalies congénitales, comme celles liées aux expositions environnementales et toxiques et celles qui sont aléatoires et inexpliquées, ne sont pas fondées sur la génétique et peuvent ne pas être détectées au moyen d’un dépistage génétique.
Le test de dépistage de porteur détermine si l’un ou l’autre des parents ou les deux sont porteurs d’un certain nombre de maladies héréditaires. Il permet si les tests montrent que les deux parents sont porteurs d’une mutation génétique donnée, de calculer le risque de transmission de cette maladie à leurs enfants. Parce que ces tests ont lieu avant la grossesse, les couples peuvent prendre des décisions éclairées concernant leur famille future.
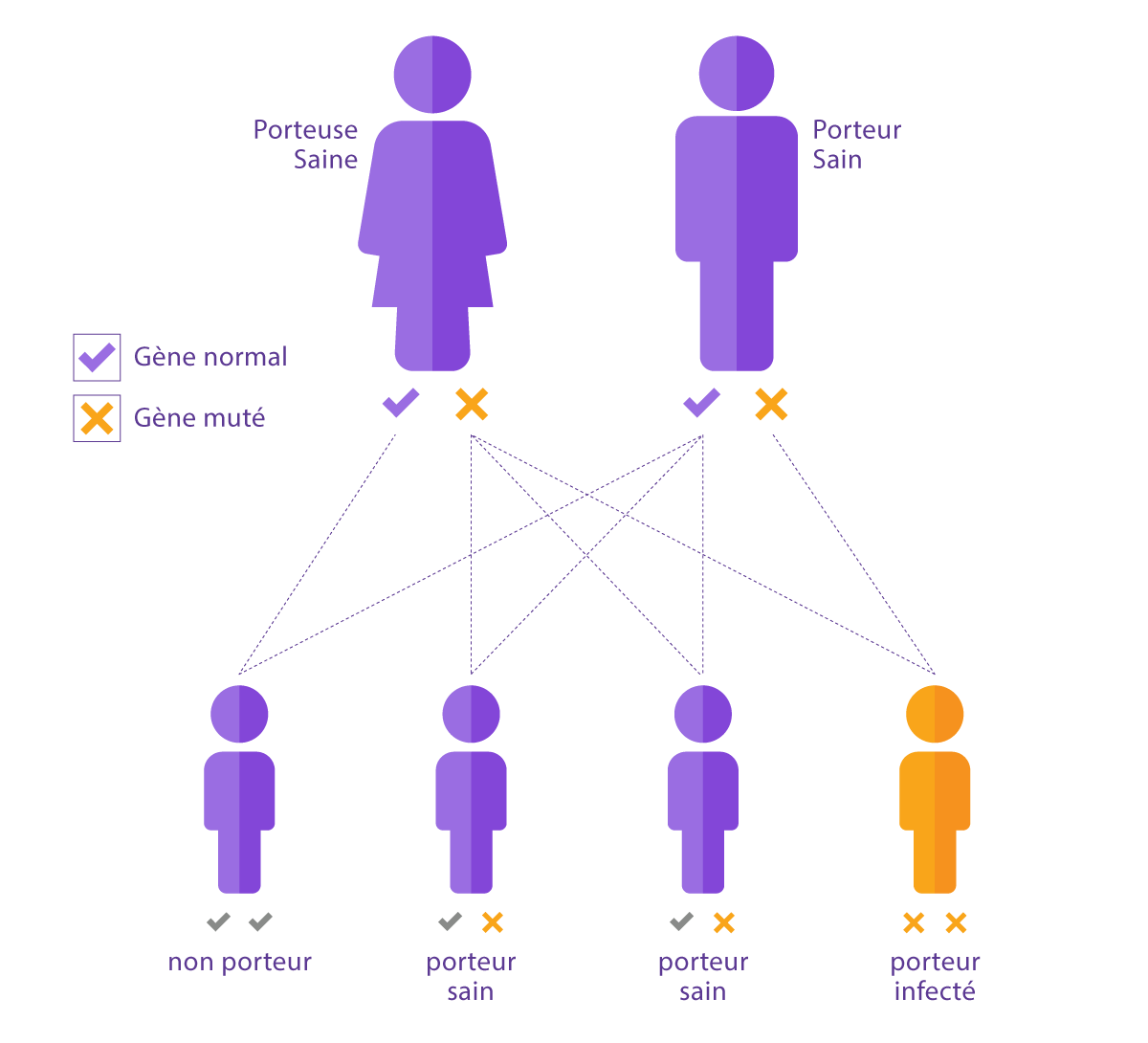
10 enfants sur 1000 naissent avec des maladies génétiques. Si les deux parents sont porteurs, la probabilité qu'un enfant contracte la maladie est de 25 %.
Le dépistage des maladies génétiques qui peuvent toucher les enfants dépend de l’origine raciale ou ethnique du couple, de ses antécédents familiaux et médicaux et des conditions connexes. Divers groupes raciaux et ethniques montrent une prévalence accrue de maladies spécifiques, et les couples de ces origines peuvent voir leur statut de porteur examiné en conséquence, comme décrit ci-dessous. La plupart des couples font vérifier leur statut de porteur s’il y a des antécédents familiaux de la maladie ou s’ils appartiennent à un groupe racial ou ethnique à risque.
Ce test est disponible pour tout le monde. Vous n’avez pas besoin d’être un couple FIV pour accéder au dépistage génétique de Fertinord. Il peut être réalisé chez vous et vous pouvez profiter de notre vaste réseau de collecte de pathologies.
Pourquoi vous devriez envisager le dépistage des porteurs génétiques ?- Comprendre l’information génétique combinée de votre partenaire et vous-même, afin que vous puissiez prendre des décisions éclairées sur vos options de conception.
- Aucune seringue ou structure médicale n’est nécessaire - c’est un test de salive facile à utiliser que vous pouvez faire à la maison.
- Notre équipe d’experts en conseil génétique et nos spécialistes en fertilité sont à votre disposition pour vous aider et vous conseiller sur vos options.
- Ce test vous aidera à déterminer vos risques d’avoir un bébé avec des maladies à gène unique, y compris la mucoviscidose, l’atrophie musculaire spinale et le syndrome de l'X fragile. Environ 1 couple sur 20 qui réalise un dépistage génétique de porteur découvrira qu’il a un risque accru d’avoir un enfant avec une anomalie génétique.
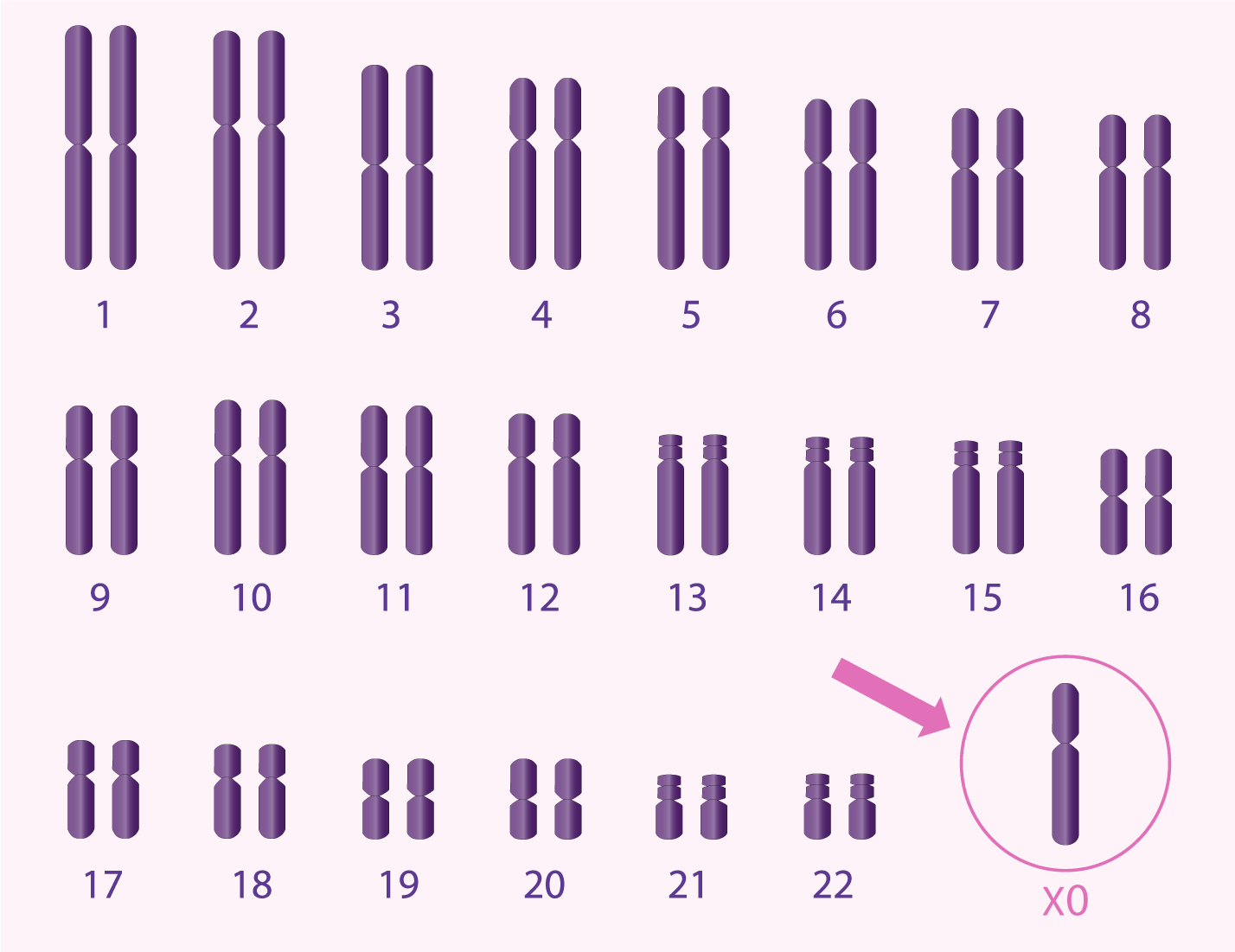
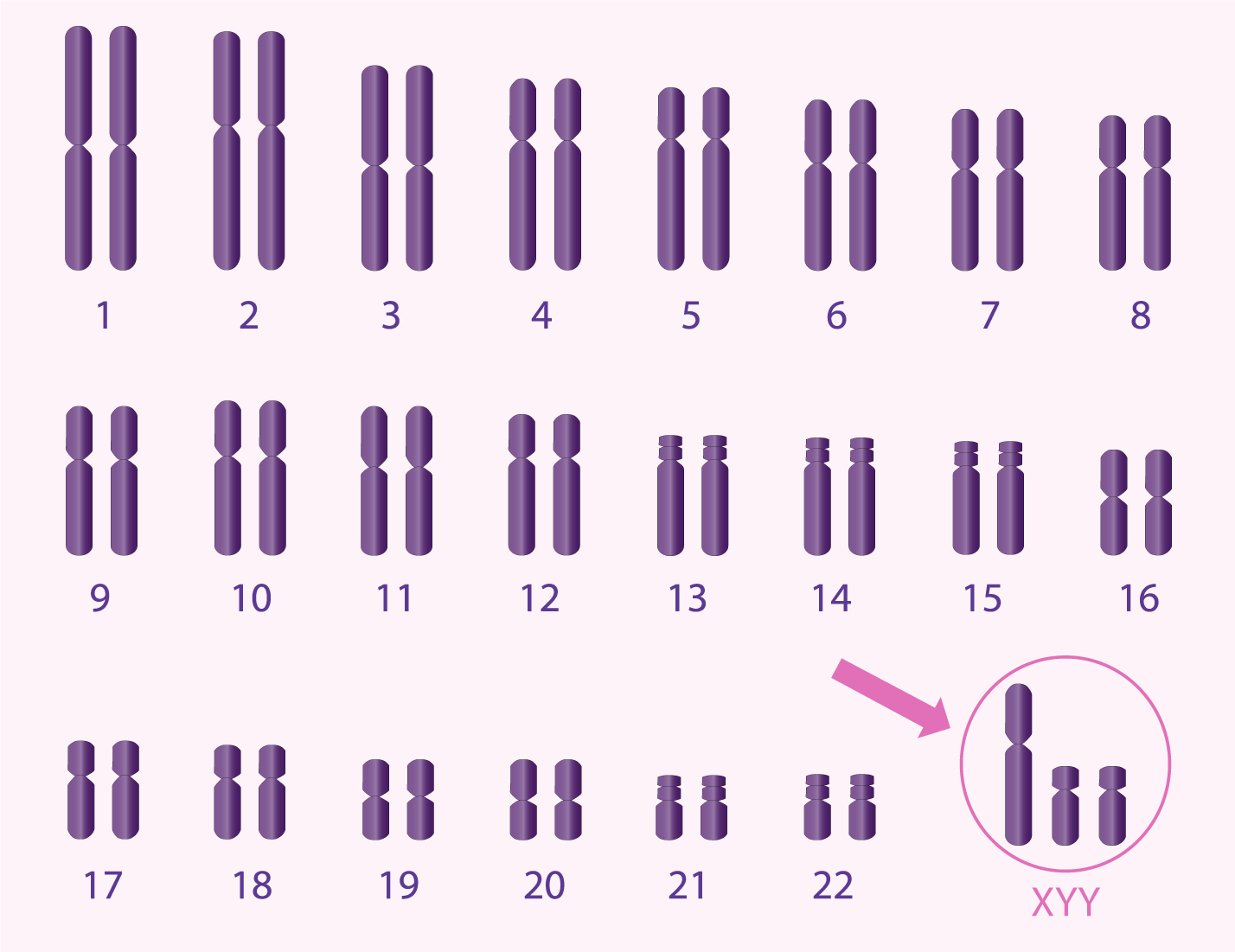
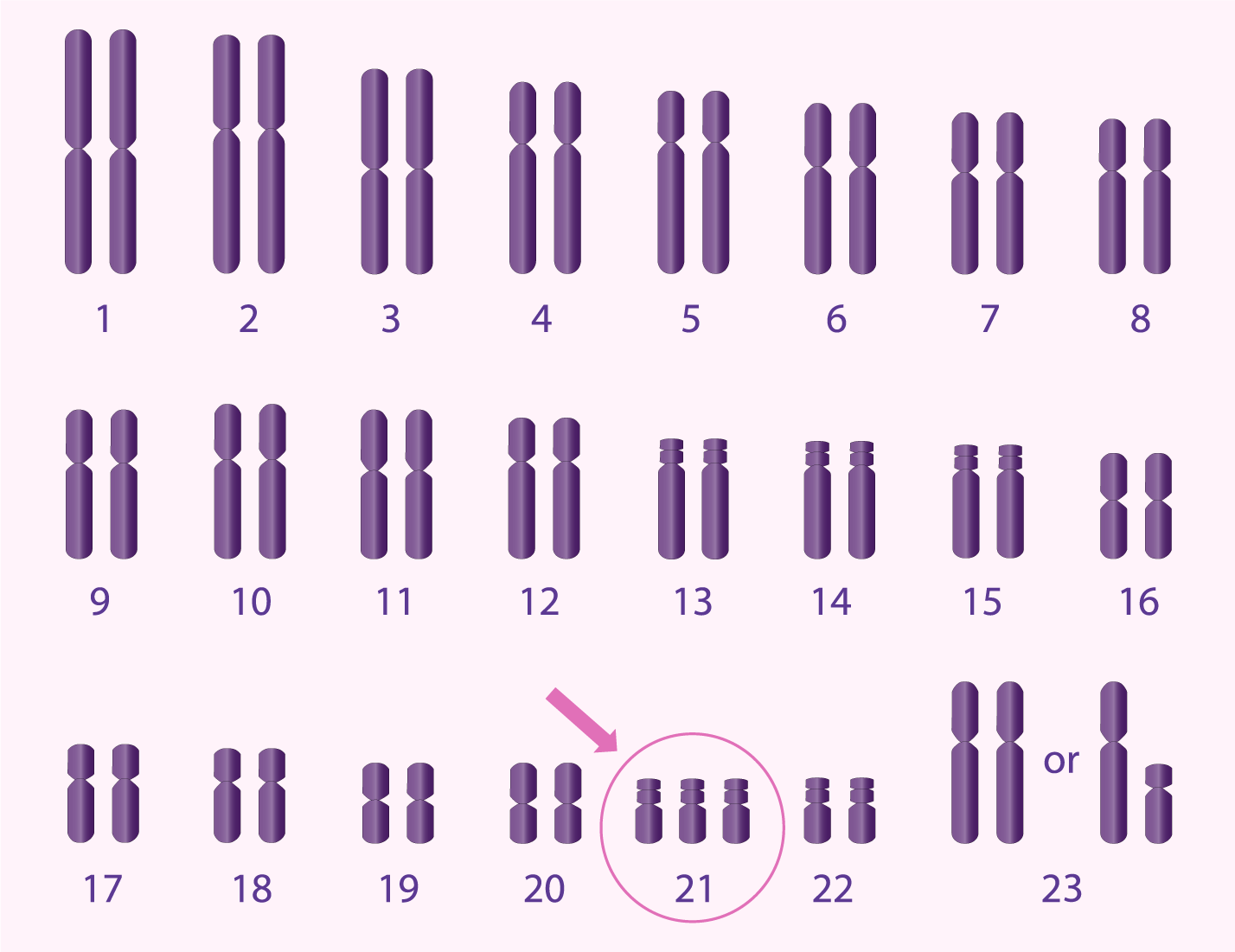
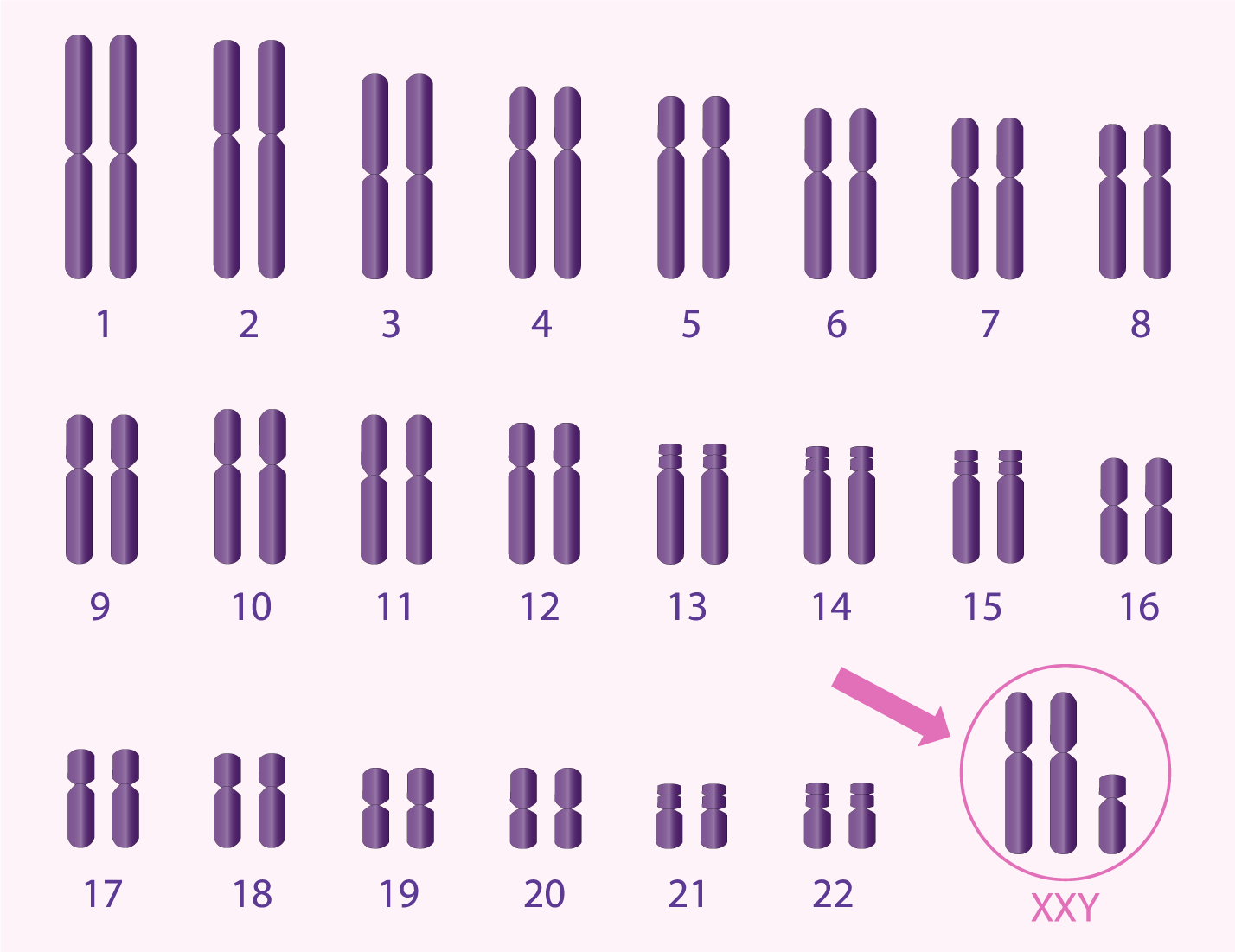
Anomalies chromosomiques
- 99% de certitude que l’embryon a le bon nombre de chromosomes, ce qui augmente les chances d’une grossesse saine
- Transfert d’un seul embryon, ce qui réduit considérablement le risque de gestation multiple. Le taux de grossesse après le transfert d’un seul embryon normal examiné est le même que celui après le transfert de deux embryons non examinés.
- augmente les chances de réussite de l’implantation embryonnaire
- réduit le besoin de plusieurs cycles de FIV
- réduit les taux de fausses couches
- réduit le risque de cycles de FIV infructueux
- femmes souffrant d’infertilité liée à l’âge
- femmes dont les cycles ont échoué
- Les femmes avec des échecs inexpliqués de FIV
- les femmes qui font plusieurs fausses couches
- stérilité masculine
- Augmente le taux de réussite de la FIV
- Augmente les chances d’implantation embryonnaire
- Augmente les chances d’un bébé génétiquement sain
- Réduit le risque d’échec des cycles de FIV
- Réduit le risque de fausse couche
Les embryons sont cultivés jusqu’au jour 5 et des cellules sont retirées de la couche externe de l’embryon (« biopsie embryonnaire ») puis envoyées au laboratoire de génétique pour analyse. Les embryons sont congelés après la biopsie.
Pendant que nous effectuons les tests génétiques, vos embryons restent congelés et entreposés. Lorsque nous identifions les embryons ayant les plus grandes chances d’implantation, ils sont transférés individuellement dans un cycle programmé de décongélation.
Comment les cellules sont-elles analysées ?La technologie utilisée pour analyser l’ADN est connue sous le nom de NGS (Next Generation Sequency/séquençage de nouvelle génération). Cette technologie de pointe est disponible à Fertinord.
L’ADN est amplifié à des millions de copies à partir de quelques cellules, et le séquenceur analyse ensuite les fragments d’ADN et les compare au génome humain (la carte standard des gènes humains).
Un logiciel spécialisé est utilisé pour déterminer les différents fragments de chaque chromosome, et détecte s'il y a un chromosome supplémentaire ou manquant.
Il faut 2-3 semaines pour recevoir les résultats de ces tests, après quoi votre spécialiste de la fertilité peut discuter avec vous des embryons qui sont les plus appropriés pour le transfert. Les embryons qui ont un nombre typique de chromosomes ont les plus grandes chances d’implantation et de grossesse réussie.
Évaluation des résultats PGT-A (aneuploïdie)PGT-M consiste à tester des embryons pour des troubles monogéniques spécifiques comme la thalassémie, l’hémophilie et certains types de dystrophie musculaire. Il aide les couples qui ont des antécédents familiaux ou qui ont eu un enfant atteint de ces troubles à avoir un enfant non touché. Tous les embryons formés dans le cadre d’une technique de procréation assistée (AMP) sont testés pour ce trouble monogénique spécifique. Seuls les embryons non affectés sont transférés pour avoir un enfant sans maladie. Cela peut également être combiné avec PGT-A pour améliorer encore les taux de réussite.
Si vous ou votre partenaire avez des antécédents familiaux de maladie génétique héréditaire, PGT-M est votre meilleur outil pour arrêter le cycle et prévenir la transmission à vos enfants.
C’est pour qui ?Le PGT-M est destiné à toutes les personnes ou tous les couples qui présentent un risque élevé connu d'avoir un enfant atteint d'une maladie monogénique. Les exemples comprennent:
- Les personnes qui ont des antécédents personnels et/ou familiaux de maladie génétique, comme le cancer héréditaire du sein et des ovaires (BRCA1/2) ou la maladie de Huntington.
- Les couples qui sont tous deux porteurs connus d'une maladie récessive, telle que la fibrose kystique ou la drépanocytose.
- Les personnes porteuses ou atteintes d'une maladie génétique liée à l'X, comme le syndrome de l'X fragile ou la dystrophie musculaire de Duchenne/Becker.
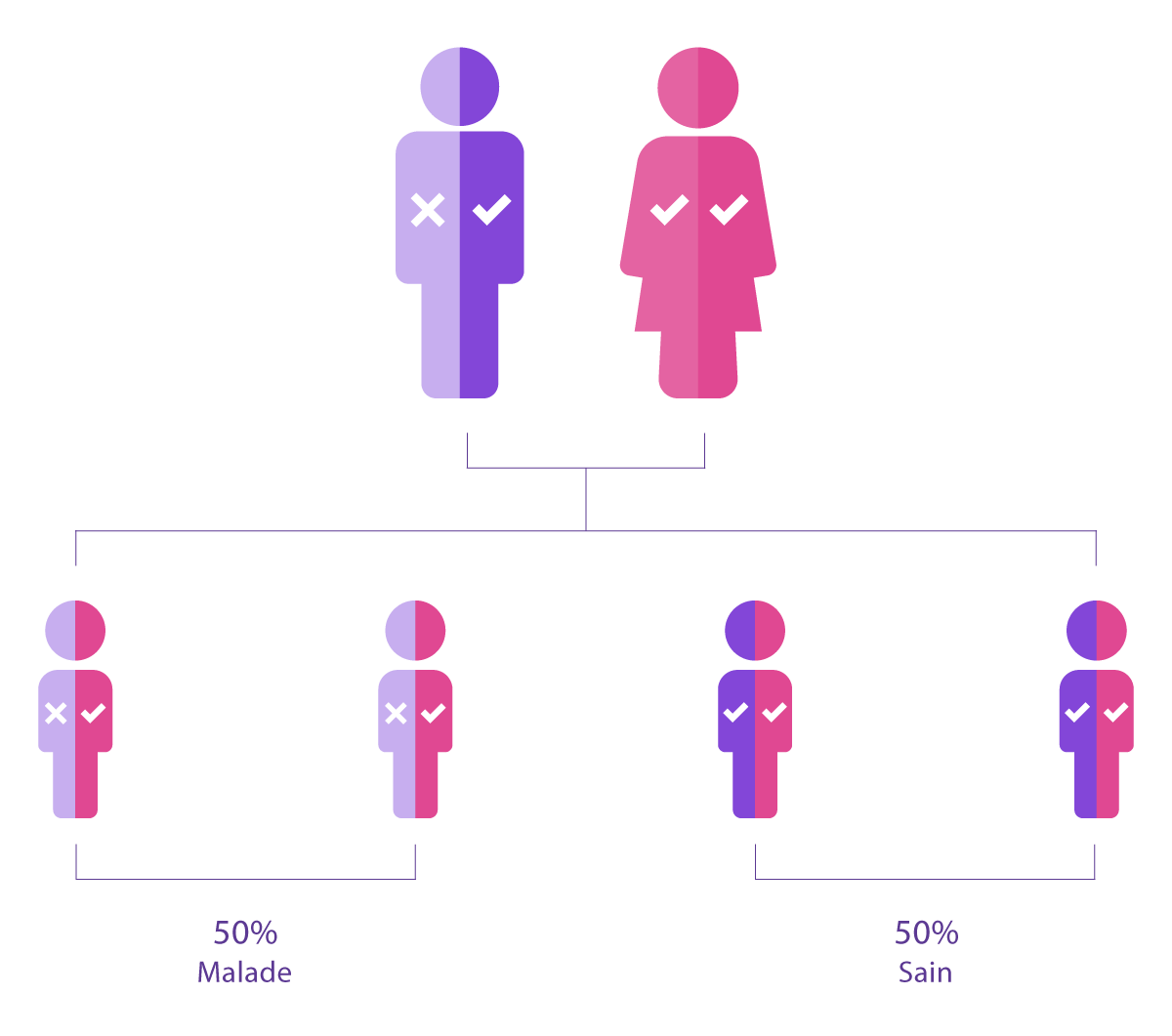
Qu'une mutation héréditaire cause ou non une maladie chez un individu dépend du type de modèle d'hérédité suivi par ce gène particulier. Par exemple, certaines conditions suivent un modèle autosomique dominant, dans lequel avoir une mutation sur une seule copie du gène est suffisant pour causer la maladie. Dans ces cas, un individu porteur d’une mutation dominante est affecté par la maladie et a donc 50% de risques de la transmettre à son enfant.
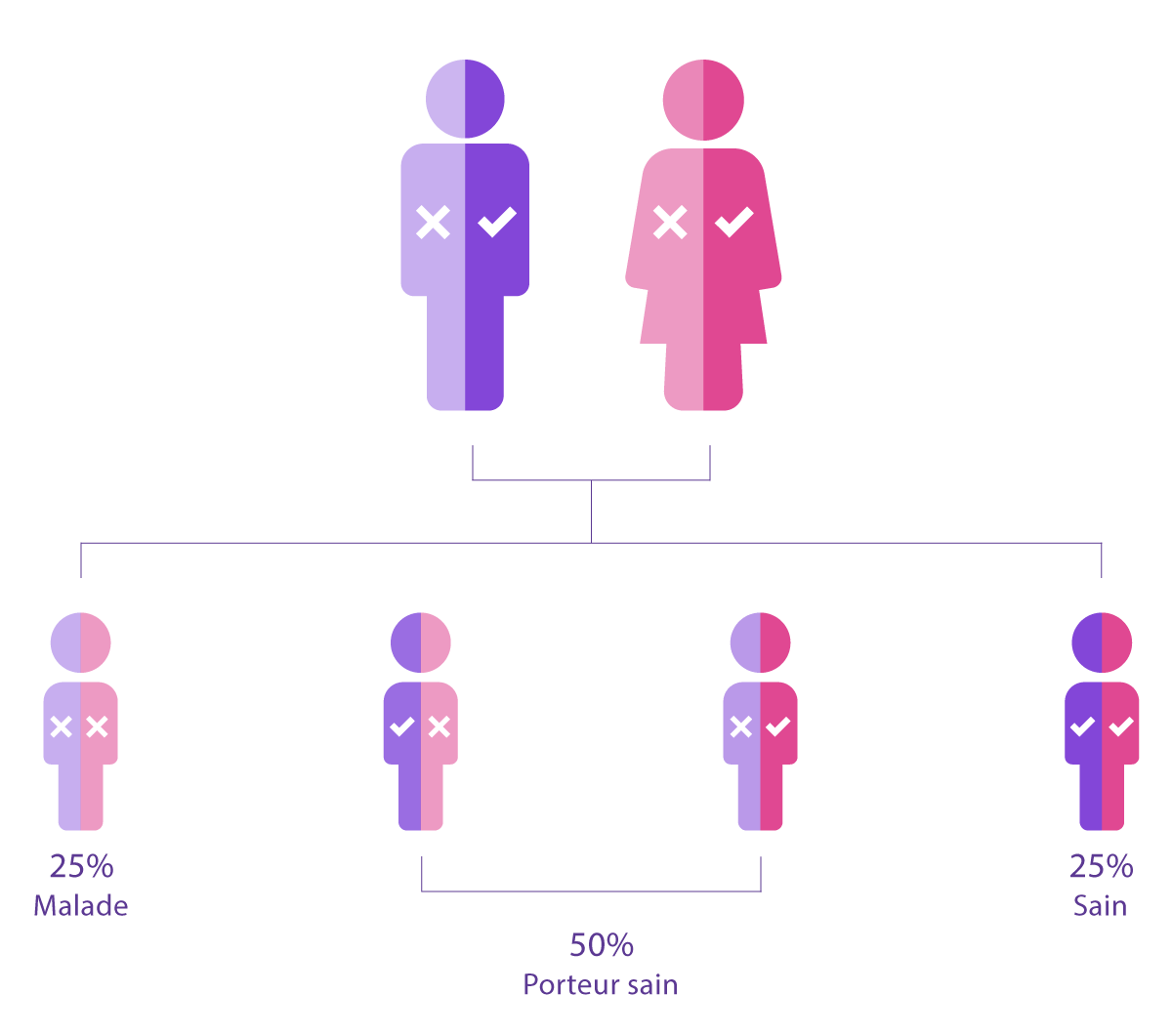
D'autre part, les maladies qui suivent un schéma autosomique récessif nécessitent une mutation sur les deux copies d'un gène pour provoquer la maladie. Dans ce cas, les deux parents sont généralement porteurs sains d'une mutation du même gène et auraient 25 % de risques d'avoir un enfant qui hérite des deux mutations et serait donc atteint de la maladie.
Quels sont les avantages ?- Il permet d'analyser des embryons pour plus de 400 maladies héréditaires avant la FIV.
- Réduisez votre risque de transmettre des anomalies génétiques à votre enfant.
- Augmentez vos chances de naissance saine.
- Néphropathie polykystique autosomique dominante
- Dystrophie musculaire de Becker
- Bêta-thalassémie
- Mucoviscidose
- Maladie de Charcot-Marie-Tooth de type 1A
- Dystrophie musculaire de Duchenne
- Polyneuropathie amyloïde familiale
- Syndrome de l'X fragile
- Hémophilie A (F8)
- Hémophilie B (F9)
- Maladie de Huntington
- Néoplasie endocrinienne multiple, type 2A
- Dystrophie myotonique (maladie de Steinert)
- Incompatibilité avec le RhD
- Atrophie musculaire spinale
La méthode la plus courante pour tester les embryons est un processus appelé « karyomapping ». Cette technique avancée utilise la technologie d’empreinte génétique pour identifier quels embryons ont hérité de la variante génétique connue dans la famille. Les embryons sont cultivés jusqu’au jour 5 et des cellules sont retirées de la couche externe de l’embryon (« biopsie embryonnaire ») puis envoyées au laboratoire de génétique pour analyse. Le test peut également identifier les changements chromosomiques communs qui ont un impact sur le risque d’implantation et de fausse couche.
Le PGT-M est plus compliqué que le PGT-A. Le processus d’élaboration des essais du PGT-M prend au moins 4 à 6 mois.
PGT-SR teste les personnes avec des réarrangements chromosomiques (les structures qui contiennent le matériel génétique ne sont pas de taille ou d’arrangement normal). Ces personnes risquent de produire des embryons dont la structure chromosomique est déséquilibrée. De tels embryons ne sont pas viables et peuvent entraîner de multiples fausses couches. PGT-SR teste les embryons pour ces réarrangements spécifiques et peut aider dans la sélection des embryons normaux pour le transfert.
C’est pour qui ?PGT-SR est destiné aux personnes qui ont un réarrangement chromosomique connu ou une inversion dans la famille.
Les réarrangements chromosomiques structurels sont une cause génétique héréditaire de la perte récurrente de grossesse. Si vous avez des antécédents de fausses couches multiples, consultez votre médecin pour savoir si vous avez besoin d’une analyse plus approfondie et si le PGT-SR est une option pour vous.
1. Translocation réciproque:
Les translocations réciproques se produisent lorsque deux chromosomes distincts échangent de grands segments d’ADN, conduisant à des chromosomes dérivés qui contiennent de l’ADN de deux sources chromosomiques différentes. Lorsque des translocations réciproques se produisent de manière équilibrée -- c’est-à-dire qu’aucun ADN n’a été perdu lorsque les morceaux ont été échangés -- la personne transportant ladite translocation est en bonne santé. Toutefois, lorsque cette personne envisage de concevoir ses propres enfants, il est difficile pour l’ADN de se diviser correctement dans les spermatozoïdes ou les ovules afin de transmettre la moitié de l’ADN nécessaire au développement de l’embryon.
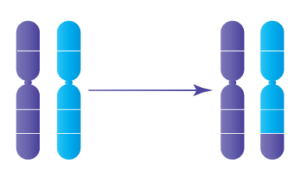
Translocation réciproque déséquilibrée
En fait, l’ADN ne se divise généralement pas correctement dans la majorité des cas, ce qui entraîne des gamètes déséquilibrés et donc des embryons déséquilibrés -- aussi appelés embryons aneuploïdes. La plupart des formes d’aneuploïdie ne mènent généralement pas à des grossesses réussies; au contraire, elle conduit à un échec de l’implantation ou une fausse couche, généralement dans le premier trimestre. Certaines formes d’aneuploïdie peuvent mener à la naissance d’un enfant atteint d’un trouble génétique grave; le risque que cela se produise pour un individu ayant une translocation réciproque varie en fonction des points de rupture de translocation spécifiques. D’autre part, les embryons sans aneuploïdie (également appelés embryons euploïdes ou équilibrés) ont les meilleures chances de mener à une grossesse réussie et un bébé en bonne santé.
2. Translocation Robertsonienne:
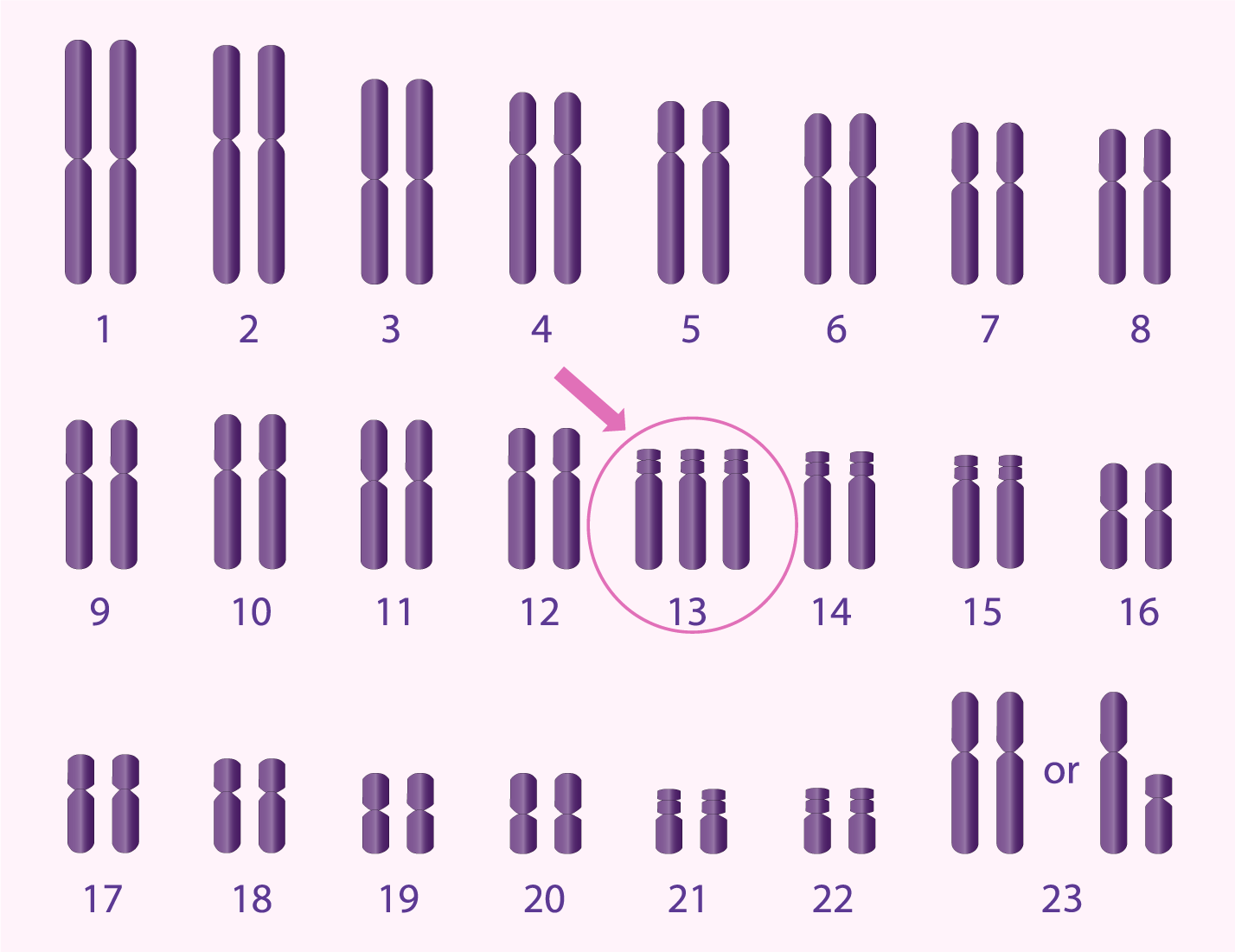
Les translocations robertsoniennes sont semblables aux translocations réciproques en ce sens qu’il y a un échange atypique d’ADN entre différents chromosomes, mais dans ce cas, seuls les chromosomes acrocentriques sont en cause. . .-il s’agit de chromosomes dont la majorité de l’ADN se trouve sur une section du chromosome (appelée le bras q), tandis que l’autre section (le bras p) est très petite et ne contient pas de matériel génétique essentiel. Seuls les chromosomes suivants sont considérés comme acrocentriques : 13, 14, 15, 21 et 22. Lorsqu’une translocation robertsonienne se produit, les bras q de chaque chromosome acrocentrique se joignent pour former un chromosome dérivé plus grand, tandis que les bras p sont éliminés. Les individus ayant une translocation robertsonienne auront donc 45 chromosomes au total plutôt que les 46 habituels.
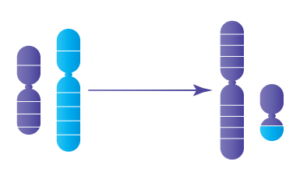
Translocation Robertsonienne
Parce que l’ADN essentiel reste intact, les individus avec des translocations robertsoniennes ont tout l’ADN nécessaire au développement normal et sont en bonne santé. Toutefois, lorsque cette personne envisage d'avoir ses propres enfants, il est difficile pour l’ADN de se diviser correctement dans les spermatozoïdes ou les ovules (aussi appelés gamètes) afin de transmettre la moitié de l’ADN nécessaire au développement de l’embryon. En fait, l’ADN ne se divise généralement pas correctement dans la majorité des cas, ce qui entraîne des gamètes déséquilibrés et donc des embryons déséquilibrés -- aussi appelés embryons aneuploïdes. La plupart des formes d’aneuploïdie ne mènent généralement pas à des grossesses réussies; au contraire, elle conduit à un échec de l’implantation ou une fausse couche, généralement dans le premier trimestre. Certaines formes d’aneuploïdie peuvent mener à la naissance d’un enfant atteint d’un trouble génétique grave. Ceci est particulièrement préoccupant pour les individus avec des translocations robertsoniennes impliquant les chromosomes 13 et/ou 21, qui sont associés aux conditions génétiques connues du syndrome de Patau et du syndrome de Down, respectivement. D’autre part, les embryons sans aneuploïdie (également appelés embryons euploïdes ou équilibrés) ont les meilleures chances de mener à une grossesse réussie et un bébé en bonne santé.
3. Inversions:
Les inversions se produisent lorsqu’il y a deux ruptures dans un seul chromosome et que le segment séparé est inversé avant d’être réinséré dans le chromosome. Il existe deux types d’inversions : péricentrique et paracentrique. Les inversions péricentriques sont celles où le centromère (la région du chromosome qui contrôle la division de l’ADN pendant la division cellulaire) est inclus dans la section de l’ADN qui est inversée. Les inversions paracentriques sont celles où le centromère n’est pas inclus dans la partie inversée et se trouve plutôt en dehors de l’inversion.
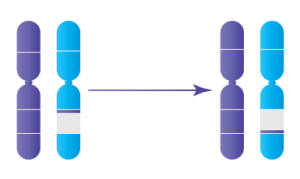
Inversions Paracentriques
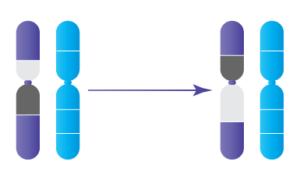
Inversions Péricentriques
Bien que la plupart des personnes qui présentent des inversions n’aient aucun problème de santé associé à l’inversion, lorsque ces personnes envisagent de concevoir leurs, il est difficile pour l’ADN de se diviser correctement dans les spermatozoïdes ou les ovules afin de transmettre la moitié de l’ADN nécessaire au développement embryonnaire. Lorsque l’ADN ne se divise pas correctement, cela conduit à des gamètes non viables et/ou déséquilibrés (ce qui signifie qu’il y a un ADN supplémentaire ou manquant et/ou un centromère supplémentaire ou manquant) et donc des embryons déséquilibrés -- également appelés embryons aneuploïdes. La plupart des formes d’aneuploïdie ne mènent généralement pas à des grossesses réussies; au contraire, elle conduit à un échec de l’implantation ou une fausse couche, généralement dans le premier trimestre. Certaines formes d’aneuploïdie peuvent mener à la naissance d’un enfant atteint d’un trouble génétique grave; le risque que cela se produise dans le cas d’une inversion dépend de la taille de l’inversion. D’autre part, les embryons sans aneuploïdie (également appelés embryons euploïdes ou équilibrés) ont les meilleures chances de mener à une grossesse réussie et un bébé en bonne santé.
4. Délétions:
Les délétions se produisent lorsqu’un chromosome se brise et qu’un certain matériel génétique est perdu. Les délétions peuvent être grandes ou petites, et peuvent se produire n’importe où le long d’un chromosome.
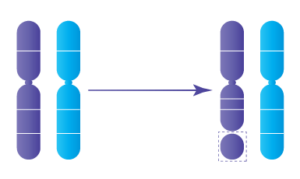
Délétions
5. Duplications:
Les duplications se produisent lorsqu’une partie d’un chromosome est anormalement copiée (dupliquée). Ce type de changement chromosomique entraîne des copies supplémentaires du matériel génétique du segment dupliqué.
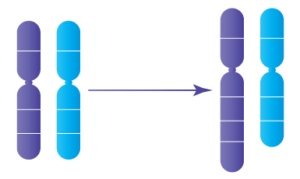
Duplications
6. Insertions:
Une partie d'un chromosome s'insère dans une position inhabituelle au sein du chromosome lui-même ou dans un autre chromosome. Si aucun chromosome n'est ajouté ni perdu, la personne ne sera pas affectée.
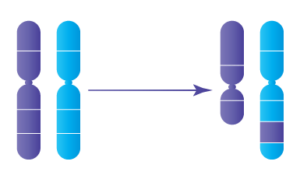
Insertions
7. Chromosome en Anneau:
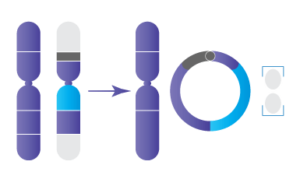
Chromosome en Anneaux
Les chromosomes circulaires se produisent habituellement lorsqu’un chromosome se brise à deux endroits, généralement aux extrémités des bras p et q, puis les bras fusionnent ensemble pour former une structure circulaire. L’anneau peut inclure ou non le centromère, selon l’endroit sur le chromosome où les ruptures se produisent. Dans de nombreux cas, le matériel génétique près des extrémités du chromosome est perdu.
De nombreuses cellules cancéreuses ont également des changements dans leur structure chromosomique. Ces changements ne sont pas héréditaires; ils se produisent dans les cellules somatiques (cellules autres que les ovules ou les spermatozoïdes) pendant la formation ou la progression d’une tumeur cancéreuse.
Comment le PGT-SR est-il effectué?Dans la plupart des cas, le processus du PGT-SR suit un processus plus simple, semblable au PGT-A et ne nécessite aucun test supplémentaire. Dans certains cas, il peut être nécessaire d’effectuer un travail plus approfondi et de suivre un cheminement semblable à celui du PGT-M.
De nombreuses femmes qui subissent une FIV sont incapables de tomber enceintes, même après avoir transféré des embryons de bonne qualité. Bien qu'un embryon de bonne qualité soit un point de départ important, il est également important de transférer l'embryon dans un utérus prêt à recevoir l'embryon. Le moment du transfert embryonnaire doit être coordonné avec le cycle menstruel, ni trop tôt ni trop tard, mais au bon moment. Pour la plupart des femmes, le meilleur moment pour transférer un embryon est le même, mais pour certaines femmes, il peut être différent.
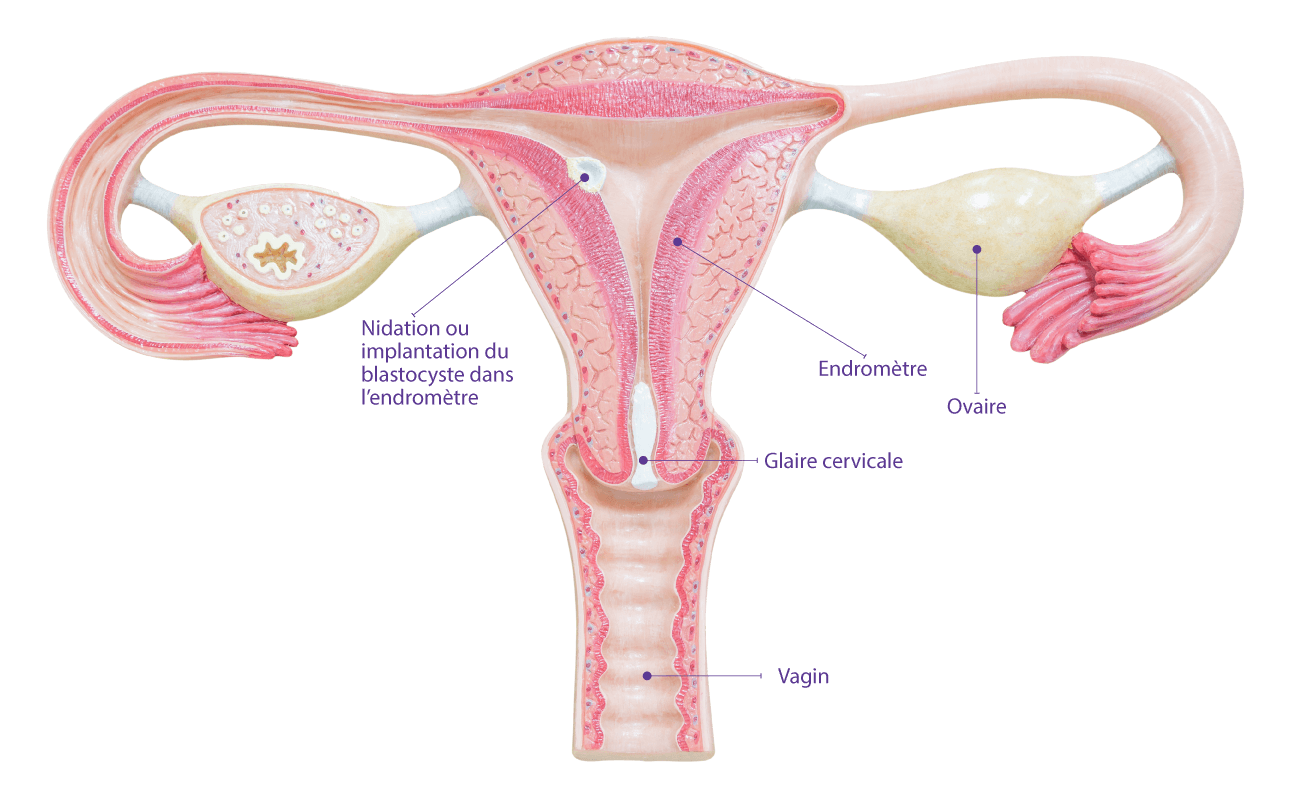
Qu'est-ce que l'endomètre ?L'intérieur de l'utérus est tapissé d'un tissu appelé endomètre, qui est préparé chaque mois pour l'arrivée d'un embryon et c'est le nid où l'embryon s'implante et réside pendant la gestation. Même le meilleur embryon ne pourra pas s'implanter si les conditions ne sont pas bonnes.
Qu'est-ce que la réceptivité endométriale ?L'endomètre est réceptif lorsqu'il est prêt pour l'implantation de l'embryon. Cette période de réceptivité s'appelle la fenêtre d'implantation. Chaque femme a une fenêtre unique. Connaissant votre fenêtre d'implantation personnelle, vous pouvez optimiser vos chances de grossesse en effectuant un transfert d'embryon personnalisé.
Qu'est-ce que le test ERA ?ERA est un test génétique personnalisé pour diagnostiquer l’état de réceptivité de l’endomètre dans la fenêtre d’implantation. L’ERA détermine la période exacte pendant laquelle un embryon doit être transféré dans l’utérus de la femme pour réussir une grossesse.
C’est pour qui ?- Pour les patientes qui ont eu un échec d’implantation avec des embryons de bonne qualité morphologique (au moins 3 transferts d’embryons échoués chez les femmes de moins de 37 ans ou 2 transferts échoués chez les femmes de plus de 37 ans.)
- Pour les patientes dont l’utérus est normal et dont l’épaisseur de l’endomètre est normale (≥6 mm), où aucun problème n’est apparent.
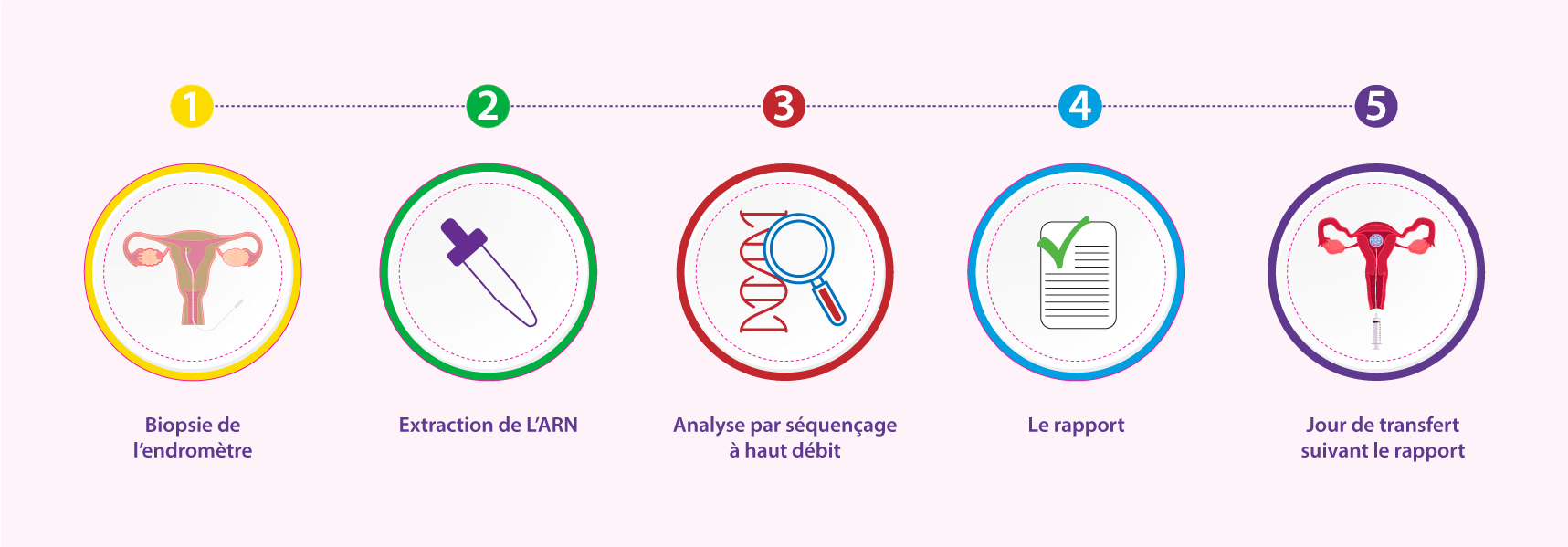
Le test d’ERA nécessite une biopsie endométriale rapide et facile.
Résultats des tests ERA:- Un résultat réceptif montre que la fenêtre d’implantation est située le jour du prélèvement de l’échantillon. La recommandation est de procéder au transfert d’embryons dans les mêmes conditions que pour la biopsie.
- Un résultat non réceptif montre une fenêtre d’implantation déplacée. Dans ce cas, avec le prédicteur computationnel ERA, nous évaluerons votre fenêtre d’implantation en indiquant quand votre transfert d’embryon personnalisé est optimal dans 90% des cas. Une deuxième biopsie sera nécessaire dans seulement 10% des cas.
Les risques pour la santé des enfants nés après un test PGT-M ou PGT-A sont très rares et sont les mêmes que pour les enfants nés après un traitement FIV normal.
La FIV avec les tests génétiques préimplantatoires comporte tous les risques du traitement conventionnel par FIV.
En plus de ceux-ci, toute personne envisageant le PGT-M/PGT-A doit également comprendre ces risques supplémentaires :
- Les taux de naissances vivantes peuvent être inférieurs à ceux des personnes de même âge. C’est parce que certains embryons ne survivront pas au processus et certains (ou tous) peuvent revenir avec de mauvais résultats.
- Les faux positifs et les faux négatifs sont possibles. En d’autres termes, les embryons qui sont anormaux peuvent être « normaux », et les embryons sains peuvent être diagnostiqués à tort comme anormaux.
- Si tous les embryons reviennent avec de mauvais résultats, il pourrait n’y en avoir aucun à transférer.
- Des résultats non concluants peuvent se produire. Aussi connus sous le nom d’embryons de mosaïque, c’est lorsque certaines cellules apparaissent chromosomiquement normales et d’autres pas au sein du même embryon. Certaines études publiées en 2017 ont révélé que les embryons de mosaïque peuvent se corriger et mener à une grossesse et à un bébé en bonne santé.
- La cryoconservation et la décongélation subséquente peuvent entraîner la perte d’embryons autrement sains.
- Certains embryons sains pourraient ne pas survivre jusqu'au jour 5.
- La biopsie des embryons du jour 3 peut conduire à l’arrêt de l’embryon (l’embryon cesse de se développer).
- PGT-M/PGT-A n’est pas infaillible, et un enfant avec une maladie ou un trouble génétique peut encore en résulter. Le dépistage prénatal en plus du PGT-M/PFT-A est recommandé pour une assurance supplémentaire.
- Un bon dépistage préimplantatoire et prénatal ne garantit pas que l’enfant ne sera pas affecté par d’autres types de handicaps physiques ou mentaux.
Services
- Diagnostic de Fertilité
- Examens de Fertilité Femme
- Examens de Fertilité Homme
- Stimulation Ovarienne
- Insémination Intra-Utérine (IIU)
- Fécondation In Vitro (FIV)
- Cas Complexes en AMP
- Congélation Ovocytaire
- Congélation du Sperme
- Congélation d’Embryons
- ICSI (injection intra-cytoplasmique de spermatozoïdes)
- IMSI (Intracytoplasmic Morphologically Selected Sperm Injection)
- Prélèvement chirurgical de sperme
- Éclosion Assistée (Hatching)
- Le Scratching Endométrial
- Transfert d’Embryons
- Vitrification
- Rajeunissement Ovarien
- Infertilité Masculine
- Tests Génétiques
- Drilling Ovarien
- Laparoscopie
- Myomectomie
- Reperméabilisation Tubaire
- Salpingectomie Pre-FIV
- Soutien aux Patients
Le diagnostic génétique préimplantatoire (DPI) est une technique scientifique très avancée pour tester, diagnostiquer et sélectionner des embryons exempts d’anomalies génétiques ou chromosomiques avant leur transfert dans l’utérus. Cela réduit le risque de transmission de maladies génétiques dévastatrices, réduit la probabilité de fausses couches récurrentes et améliore les chances de succès de la grossesse.
Un embryon normal contient 46 chromosomes qui sont hérités des deux parents pendant le processus de fécondation. Le spermatozoïde contribue par 23 chromosomes et l’ovocyte par les 23 autres. Quand un embryon est détecté pour avoir une quantité anormale de chromosomes (trop ou trop peu), il est appelé aneuploïde. La plupart des embryons ayant un nombre incorrect de chromosomes font une fausse couche ou ne parviennent pas à implanter au cours du premier trimestre de la grossesse, ce qui est connu pour causer des grossesses manquées et des malformations congénitales.
Le risque de trouver des anomalies chromosomiques augmente avec l’âge de la femme. À 40 ans, 58 % des chromosomes d’une femme sont chromosomiquement anormaux. C’est pourquoi les femmes âgées ont un tel risque de fausse couche ou de naissance avec un trouble chromosomique comme le syndrome de Down.
Les tests génétiques aident à prévenir ces résultats en identifiant les embryons touchés au cours de leur développement en laboratoire. Ils permettent de déterminer si un embryon a une quantité normale de chromosomes avant d’être transféré dans l’utérus d’une femme pendant un cycle de FIV. les couples peuvent maintenant augmenter leurs chances d’implantation, réduire leur risque de fausse couche et diminuer leur risque d’avoir un enfant atteint d’une maladie génétique. Les affections les plus courantes causées par des anomalies chromosomiques comprennent le syndrome de Down, le syndrome de Klinefelter et le syndrome de Turner.
Au Centre Fertinord, nous sommes fiers d’offrir les dernières techniques pour donner à nos couples les meilleurs soins et maximiser leurs chances d'avoir un enfant sain.
Les tests génétiques peuvent être effectués à deux étapes cruciales du cheminement d’un couple vers la parentalité : soit chez le couple avant la phase de grossesse soit sur les embryons avant la phase de transfert d’un cycle de FIV.
Ce simple test salivaire est effectué avant la grossesse. Il permet de dépister jusqu’à 410 maladies génétiques potentielles et peut aider à identifier les couples qui présentent un risque accru de troubles génétiques familiaux ou liés à l’âge et de malformations congénitales. Cependant, aucun test ne peut à lui seul prédire avec exactitude le risque de toutes les anomalies chez un enfant, et de nombreuses anomalies congénitales, comme celles liées aux expositions environnementales et toxiques et celles qui sont aléatoires et inexpliquées, ne sont pas fondées sur la génétique et peuvent ne pas être détectées au moyen d’un dépistage génétique.
Le test de dépistage de porteur détermine si l’un ou l’autre des parents ou les deux sont porteurs d’un certain nombre de maladies héréditaires. Il permet si les tests montrent que les deux parents sont porteurs d’une mutation génétique donnée, de calculer le risque de transmission de cette maladie à leurs enfants. Parce que ces tests ont lieu avant la grossesse, les couples peuvent prendre des décisions éclairées concernant leur famille future.

10 enfants sur 1000 naissent avec des maladies génétiques. Si les deux parents sont porteurs, la probabilité qu'un enfant contracte la maladie est de 25 %.
Le dépistage des maladies génétiques qui peuvent toucher les enfants dépend de l’origine raciale ou ethnique du couple, de ses antécédents familiaux et médicaux et des conditions connexes. Divers groupes raciaux et ethniques montrent une prévalence accrue de maladies spécifiques, et les couples de ces origines peuvent voir leur statut de porteur examiné en conséquence, comme décrit ci-dessous. La plupart des couples font vérifier leur statut de porteur s’il y a des antécédents familiaux de la maladie ou s’ils appartiennent à un groupe racial ou ethnique à risque.
Ce test est disponible pour tout le monde. Vous n’avez pas besoin d’être un couple FIV pour accéder au dépistage génétique de Fertinord. Il peut être réalisé chez vous et vous pouvez profiter de notre vaste réseau de collecte de pathologies.
Pourquoi vous devriez envisager le dépistage des porteurs génétiques ?- Comprendre l’information génétique combinée de votre partenaire et vous-même, afin que vous puissiez prendre des décisions éclairées sur vos options de conception.
- Aucune seringue ou structure médicale n’est nécessaire - c’est un test de salive facile à utiliser que vous pouvez faire à la maison.
- Notre équipe d’experts en conseil génétique et nos spécialistes en fertilité sont à votre disposition pour vous aider et vous conseiller sur vos options.
- Ce test vous aidera à déterminer vos risques d’avoir un bébé avec des maladies à gène unique, y compris la mucoviscidose, l’atrophie musculaire spinale et le syndrome de l'X fragile. Environ 1 couple sur 20 qui réalise un dépistage génétique de porteur découvrira qu’il a un risque accru d’avoir un enfant avec une anomalie génétique.
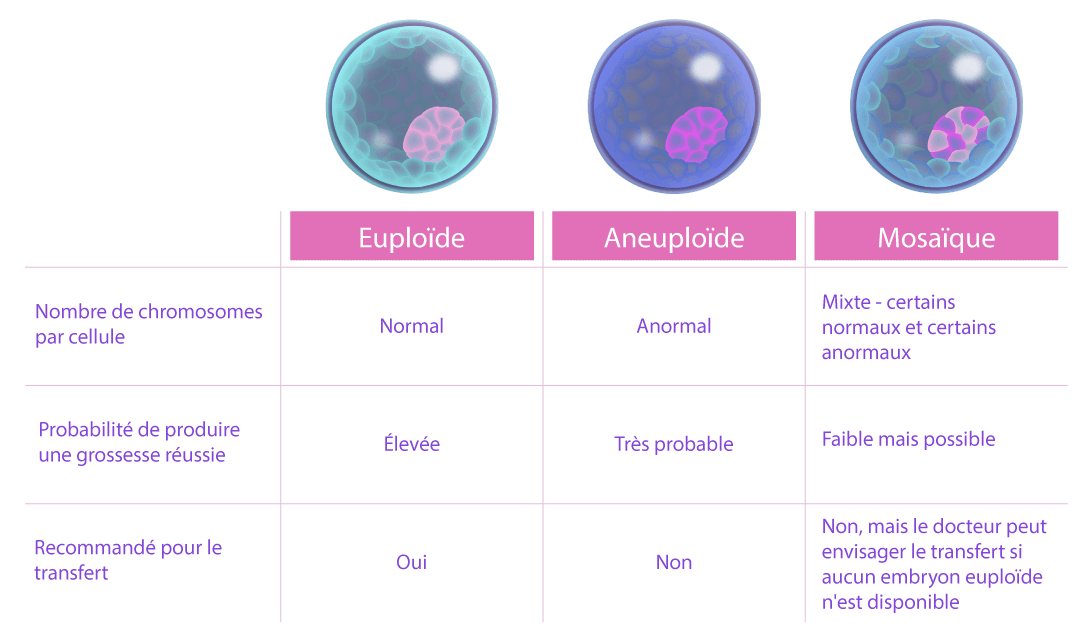
PGT-A est un test génétique effectué sur des embryons pour identifier des anomalies chromosomiques numériques ou une aneuploïdie. Ce test est effectué sur des embryons avant leur transfert dans l’utérus. En analysant tous les embryons générés dans un cycle de traitement par FIV, on peut identifier ceux qui sont exempts d’aneuploïdie chromosomique pour le transfert sélectif. Par conséquent, les taux de grossesse par transfert augmentent et les taux de fausses couches diminuent.
Anomalies chromosomiques
- 99% de certitude que l’embryon a le bon nombre de chromosomes, ce qui augmente les chances d’une grossesse saine
- Transfert d’un seul embryon, ce qui réduit considérablement le risque de gestation multiple. Le taux de grossesse après le transfert d’un seul embryon normal examiné est le même que celui après le transfert de deux embryons non examinés.
- augmente les chances de réussite de l’implantation embryonnaire
- réduit le besoin de plusieurs cycles de FIV
- réduit les taux de fausses couches
- réduit le risque de cycles de FIV infructueux
- femmes souffrant d’infertilité liée à l’âge
- femmes dont les cycles ont échoué
- Les femmes avec des échecs inexpliqués de FIV
- les femmes qui font plusieurs fausses couches
- stérilité masculine
- Augmente le taux de réussite de la FIV
- Augmente les chances d’implantation embryonnaire
- Augmente les chances d’un bébé génétiquement sain
- Réduit le risque d’échec des cycles de FIV
- Réduit le risque de fausse couche
Les embryons sont cultivés jusqu’au jour 5 et des cellules sont retirées de la couche externe de l’embryon (« biopsie embryonnaire ») puis envoyées au laboratoire de génétique pour analyse. Les embryons sont congelés après la biopsie.
Pendant que nous effectuons les tests génétiques, vos embryons restent congelés et entreposés. Lorsque nous identifions les embryons ayant les plus grandes chances d’implantation, ils sont transférés individuellement dans un cycle programmé de décongélation.
Comment les cellules sont-elles analysées ?La technologie utilisée pour analyser l’ADN est connue sous le nom de NGS (Next Generation Sequency/séquençage de nouvelle génération). Cette technologie de pointe est disponible à IRIFIV Center.
L’ADN est amplifié à des millions de copies à partir de quelques cellules, et le séquenceur analyse ensuite les fragments d’ADN et les compare au génome humain (la carte standard des gènes humains).
Un logiciel spécialisé est utilisé pour déterminer les différents fragments de chaque chromosome, et détecte s'il y a un chromosome supplémentaire ou manquant.
Il faut 2-3 semaines pour recevoir les résultats de ces tests, après quoi votre spécialiste de la fertilité peut discuter avec vous des embryons qui sont les plus appropriés pour le transfert. Les embryons qui ont un nombre typique de chromosomes ont les plus grandes chances d’implantation et de grossesse réussie.
Évaluation des résultats PGT-A (aneuploïdie)PGT-M consiste à tester des embryons pour des troubles monogéniques spécifiques comme la thalassémie, l’hémophilie et certains types de dystrophie musculaire. Il aide les couples qui ont des antécédents familiaux ou qui ont eu un enfant atteint de ces troubles à avoir un enfant non touché. Tous les embryons formés dans le cadre d’une technique de procréation assistée (AMP) sont testés pour ce trouble monogénique spécifique. Seuls les embryons non affectés sont transférés pour avoir un enfant sans maladie. Cela peut également être combiné avec PGT-A pour améliorer encore les taux de réussite.
Si vous ou votre partenaire avez des antécédents familiaux de maladie génétique héréditaire, PGT-M est votre meilleur outil pour arrêter le cycle et prévenir la transmission à vos enfants.
C’est pour qui ?Le PGT-M est destiné à toutes les personnes ou tous les couples qui présentent un risque élevé connu d'avoir un enfant atteint d'une maladie monogénique. Les exemples comprennent:
- Les personnes qui ont des antécédents personnels et/ou familiaux de maladie génétique, comme le cancer héréditaire du sein et des ovaires (BRCA1/2) ou la maladie de Huntington.
- Les couples qui sont tous deux porteurs connus d'une maladie récessive, telle que la fibrose kystique ou la drépanocytose.
- Les personnes porteuses ou atteintes d'une maladie génétique liée à l'X, comme le syndrome de l'X fragile ou la dystrophie musculaire de Duchenne/Becker.
Qu'une mutation héréditaire cause ou non une maladie chez un individu dépend du type de modèle d'hérédité suivi par ce gène particulier. Par exemple, certaines conditions suivent un modèle autosomique dominant, dans lequel avoir une mutation sur une seule copie du gène est suffisant pour causer la maladie. Dans ces cas, un individu porteur d’une mutation dominante est affecté par la maladie et a donc 50% de risques de la transmettre à son enfant.
D'autre part, les maladies qui suivent un schéma autosomique récessif nécessitent une mutation sur les deux copies d'un gène pour provoquer la maladie. Dans ce cas, les deux parents sont généralement porteurs sains d'une mutation du même gène et auraient 25 % de risques d'avoir un enfant qui hérite des deux mutations et serait donc atteint de la maladie.
Quels sont les avantages ?- Il permet d'analyser des embryons pour plus de 400 maladies héréditaires avant la FIV.
- Réduisez votre risque de transmettre des anomalies génétiques à votre enfant.
- Augmentez vos chances de naissance saine.
- Néphropathie polykystique autosomique dominante
- Dystrophie musculaire de Becker
- Bêta-thalassémie
- Mucoviscidose
- Maladie de Charcot-Marie-Tooth de type 1A
- Dystrophie musculaire de Duchenne
- Polyneuropathie amyloïde familiale
- Syndrome de l'X fragile
- Hémophilie A (F8)
- Hémophilie B (F9)
- Maladie de Huntington
- Néoplasie endocrinienne multiple, type 2A
- Dystrophie myotonique (maladie de Steinert)
- Incompatibilité avec le RhD
- Atrophie musculaire spinale
La méthode la plus courante pour tester les embryons est un processus appelé « karyomapping ». Cette technique avancée utilise la technologie d’empreinte génétique pour identifier quels embryons ont hérité de la variante génétique connue dans la famille. Les embryons sont cultivés jusqu’au jour 5 et des cellules sont retirées de la couche externe de l’embryon (« biopsie embryonnaire ») puis envoyées au laboratoire de génétique pour analyse. Le test peut également identifier les changements chromosomiques communs qui ont un impact sur le risque d’implantation et de fausse couche.
Le PGT-M est plus compliqué que le PGT-A. Le processus d’élaboration des essais du PGT-M prend au moins 4 à 6 mois.
PGT-SR teste les personnes avec des réarrangements chromosomiques (les structures qui contiennent le matériel génétique ne sont pas de taille ou d’arrangement normal). Ces personnes risquent de produire des embryons dont la structure chromosomique est déséquilibrée. De tels embryons ne sont pas viables et peuvent entraîner de multiples fausses couches. PGT-SR teste les embryons pour ces réarrangements spécifiques et peut aider dans la sélection des embryons normaux pour le transfert.
C’est pour qui ?PGT-SR est destiné aux personnes qui ont un réarrangement chromosomique connu ou une inversion dans la famille.
Les réarrangements chromosomiques structurels sont une cause génétique héréditaire de la perte récurrente de grossesse. Si vous avez des antécédents de fausses couches multiples, consultez votre médecin pour savoir si vous avez besoin d’une analyse plus approfondie et si le PGT-SR est une option pour vous.
1. Translocation réciproque:
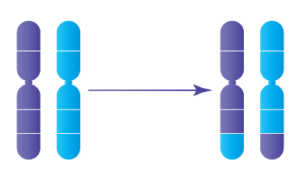
Les translocations réciproques se produisent lorsque deux chromosomes distincts échangent de grands segments d’ADN, conduisant à des chromosomes dérivés qui contiennent de l’ADN de deux sources chromosomiques différentes. Lorsque des translocations réciproques se produisent de manière équilibrée -- c’est-à-dire qu’aucun ADN n’a été perdu lorsque les morceaux ont été échangés -- la personne transportant ladite translocation est en bonne santé. Toutefois, lorsque cette personne envisage de concevoir ses propres enfants, il est difficile pour l’ADN de se diviser correctement dans les spermatozoïdes ou les ovules afin de transmettre la moitié de l’ADN nécessaire au développement de l’embryon.

Translocation réciproque déséquilibrée
En fait, l’ADN ne se divise généralement pas correctement dans la majorité des cas, ce qui entraîne des gamètes déséquilibrés et donc des embryons déséquilibrés -- aussi appelés embryons aneuploïdes. La plupart des formes d’aneuploïdie ne mènent généralement pas à des grossesses réussies; au contraire, elle conduit à un échec de l’implantation ou une fausse couche, généralement dans le premier trimestre. Certaines formes d’aneuploïdie peuvent mener à la naissance d’un enfant atteint d’un trouble génétique grave; le risque que cela se produise pour un individu ayant une translocation réciproque varie en fonction des points de rupture de translocation spécifiques. D’autre part, les embryons sans aneuploïdie (également appelés embryons euploïdes ou équilibrés) ont les meilleures chances de mener à une grossesse réussie et un bébé en bonne santé.
2. Translocation Robertsonienne:
Les translocations robertsoniennes sont semblables aux translocations réciproques en ce sens qu’il y a un échange atypique d’ADN entre différents chromosomes, mais dans ce cas, seuls les chromosomes acrocentriques sont en cause. . .-il s’agit de chromosomes dont la majorité de l’ADN se trouve sur une section du chromosome (appelée le bras q), tandis que l’autre section (le bras p) est très petite et ne contient pas de matériel génétique essentiel. Seuls les chromosomes suivants sont considérés comme acrocentriques : 13, 14, 15, 21 et 22. Lorsqu’une translocation robertsonienne se produit, les bras q de chaque chromosome acrocentrique se joignent pour former un chromosome dérivé plus grand, tandis que les bras p sont éliminés. Les individus ayant une translocation robertsonienne auront donc 45 chromosomes au total plutôt que les 46 habituels.

Translocation Robertsonienne
Parce que l’ADN essentiel reste intact, les individus avec des translocations robertsoniennes ont tout l’ADN nécessaire au développement normal et sont en bonne santé. Toutefois, lorsque cette personne envisage d'avoir ses propres enfants, il est difficile pour l’ADN de se diviser correctement dans les spermatozoïdes ou les ovules (aussi appelés gamètes) afin de transmettre la moitié de l’ADN nécessaire au développement de l’embryon. En fait, l’ADN ne se divise généralement pas correctement dans la majorité des cas, ce qui entraîne des gamètes déséquilibrés et donc des embryons déséquilibrés -- aussi appelés embryons aneuploïdes. La plupart des formes d’aneuploïdie ne mènent généralement pas à des grossesses réussies; au contraire, elle conduit à un échec de l’implantation ou une fausse couche, généralement dans le premier trimestre. Certaines formes d’aneuploïdie peuvent mener à la naissance d’un enfant atteint d’un trouble génétique grave. Ceci est particulièrement préoccupant pour les individus avec des translocations robertsoniennes impliquant les chromosomes 13 et/ou 21, qui sont associés aux conditions génétiques connues du syndrome de Patau et du syndrome de Down, respectivement. D’autre part, les embryons sans aneuploïdie (également appelés embryons euploïdes ou équilibrés) ont les meilleures chances de mener à une grossesse réussie et un bébé en bonne santé.
3. Inversions:
Les inversions se produisent lorsqu’il y a deux ruptures dans un seul chromosome et que le segment séparé est inversé avant d’être réinséré dans le chromosome. Il existe deux types d’inversions : péricentrique et paracentrique. Les inversions péricentriques sont celles où le centromère (la région du chromosome qui contrôle la division de l’ADN pendant la division cellulaire) est inclus dans la section de l’ADN qui est inversée. Les inversions paracentriques sont celles où le centromère n’est pas inclus dans la partie inversée et se trouve plutôt en dehors de l’inversion.

Inversions Paracentriques

Inversions Péricentriques
Bien que la plupart des personnes qui présentent des inversions n’aient aucun problème de santé associé à l’inversion, lorsque ces personnes envisagent de concevoir leurs, il est difficile pour l’ADN de se diviser correctement dans les spermatozoïdes ou les ovules afin de transmettre la moitié de l’ADN nécessaire au développement embryonnaire. Lorsque l’ADN ne se divise pas correctement, cela conduit à des gamètes non viables et/ou déséquilibrés (ce qui signifie qu’il y a un ADN supplémentaire ou manquant et/ou un centromère supplémentaire ou manquant) et donc des embryons déséquilibrés -- également appelés embryons aneuploïdes. La plupart des formes d’aneuploïdie ne mènent généralement pas à des grossesses réussies; au contraire, elle conduit à un échec de l’implantation ou une fausse couche, généralement dans le premier trimestre. Certaines formes d’aneuploïdie peuvent mener à la naissance d’un enfant atteint d’un trouble génétique grave; le risque que cela se produise dans le cas d’une inversion dépend de la taille de l’inversion. D’autre part, les embryons sans aneuploïdie (également appelés embryons euploïdes ou équilibrés) ont les meilleures chances de mener à une grossesse réussie et un bébé en bonne santé.
4. Délétions:
Les délétions se produisent lorsqu’un chromosome se brise et qu’un certain matériel génétique est perdu. Les délétions peuvent être grandes ou petites, et peuvent se produire n’importe où le long d’un chromosome.

Délétions
5. Duplications:
Les duplications se produisent lorsqu’une partie d’un chromosome est anormalement copiée (dupliquée). Ce type de changement chromosomique entraîne des copies supplémentaires du matériel génétique du segment dupliqué.

Duplications
6. Insertions:
Une partie d'un chromosome s'insère dans une position inhabituelle au sein du chromosome lui-même ou dans un autre chromosome. Si aucun chromosome n'est ajouté ni perdu, la personne ne sera pas affectée.

Insertions
7. Chromosome en Anneau:

Chromosome en Anneaux
Les chromosomes circulaires se produisent habituellement lorsqu’un chromosome se brise à deux endroits, généralement aux extrémités des bras p et q, puis les bras fusionnent ensemble pour former une structure circulaire. L’anneau peut inclure ou non le centromère, selon l’endroit sur le chromosome où les ruptures se produisent. Dans de nombreux cas, le matériel génétique près des extrémités du chromosome est perdu.
De nombreuses cellules cancéreuses ont également des changements dans leur structure chromosomique. Ces changements ne sont pas héréditaires; ils se produisent dans les cellules somatiques (cellules autres que les ovules ou les spermatozoïdes) pendant la formation ou la progression d’une tumeur cancéreuse.
Comment le PGT-SR est-il effectué?Dans la plupart des cas, le processus du PGT-SR suit un processus plus simple, semblable au PGT-A et ne nécessite aucun test supplémentaire. Dans certains cas, il peut être nécessaire d’effectuer un travail plus approfondi et de suivre un cheminement semblable à celui du PGT-M.
De nombreuses femmes qui subissent une FIV sont incapables de tomber enceintes, même après avoir transféré des embryons de bonne qualité. Bien qu'un embryon de bonne qualité soit un point de départ important, il est également important de transférer l'embryon dans un utérus prêt à recevoir l'embryon. Le moment du transfert embryonnaire doit être coordonné avec le cycle menstruel, ni trop tôt ni trop tard, mais au bon moment. Pour la plupart des femmes, le meilleur moment pour transférer un embryon est le même, mais pour certaines femmes, il peut être différent.
Qu'est-ce que l'endomètre ?L'intérieur de l'utérus est tapissé d'un tissu appelé endomètre, qui est préparé chaque mois pour l'arrivée d'un embryon et c'est le nid où l'embryon s'implante et réside pendant la gestation. Même le meilleur embryon ne pourra pas s'implanter si les conditions ne sont pas bonnes.
Qu'est-ce que la réceptivité endométriale ?L'endomètre est réceptif lorsqu'il est prêt pour l'implantation de l'embryon. Cette période de réceptivité s'appelle la fenêtre d'implantation. Chaque femme a une fenêtre unique. Connaissant votre fenêtre d'implantation personnelle, vous pouvez optimiser vos chances de grossesse en effectuant un transfert d'embryon personnalisé.
Qu'est-ce que le test ERA ?ERA est un test génétique personnalisé pour diagnostiquer l’état de réceptivité de l’endomètre dans la fenêtre d’implantation. L’ERA détermine la période exacte pendant laquelle un embryon doit être transféré dans l’utérus de la femme pour réussir une grossesse.
C’est pour qui ?- Pour les patientes qui ont eu un échec d’implantation avec des embryons de bonne qualité morphologique (au moins 3 transferts d’embryons échoués chez les femmes de moins de 37 ans ou 2 transferts échoués chez les femmes de plus de 37 ans.)
- Pour les patientes dont l’utérus est normal et dont l’épaisseur de l’endomètre est normale (≥6 mm), où aucun problème n’est apparent.
Le test d’ERA nécessite une biopsie endométriale rapide et facile.
Résultats des tests ERA:- Un résultat réceptif montre que la fenêtre d’implantation est située le jour du prélèvement de l’échantillon. La recommandation est de procéder au transfert d’embryons dans les mêmes conditions que pour la biopsie.
- Un résultat non réceptif montre une fenêtre d’implantation déplacée. Dans ce cas, avec le prédicteur computationnel ERA, nous évaluerons votre fenêtre d’implantation en indiquant quand votre transfert d’embryon personnalisé est optimal dans 90% des cas. Une deuxième biopsie sera nécessaire dans seulement 10% des cas.
Les risques pour la santé des enfants nés après un test PGT-M ou PGT-A sont très rares et sont les mêmes que pour les enfants nés après un traitement FIV normal.
La FIV avec les tests génétiques préimplantatoires comporte tous les risques du traitement conventionnel par FIV.
En plus de ceux-ci, toute personne envisageant le PGT-M/PGT-A doit également comprendre ces risques supplémentaires :
- Les taux de naissances vivantes peuvent être inférieurs à ceux des personnes de même âge. C’est parce que certains embryons ne survivront pas au processus et certains (ou tous) peuvent revenir avec de mauvais résultats.
- Les faux positifs et les faux négatifs sont possibles. En d’autres termes, les embryons qui sont anormaux peuvent être « normaux », et les embryons sains peuvent être diagnostiqués à tort comme anormaux.
- Si tous les embryons reviennent avec de mauvais résultats, il pourrait n’y en avoir aucun à transférer.
- Des résultats non concluants peuvent se produire. Aussi connus sous le nom d’embryons de mosaïque, c’est lorsque certaines cellules apparaissent chromosomiquement normales et d’autres pas au sein du même embryon. Certaines études publiées en 2017 ont révélé que les embryons de mosaïque peuvent se corriger et mener à une grossesse et à un bébé en bonne santé.
- La cryoconservation et la décongélation subséquente peuvent entraîner la perte d’embryons autrement sains.
- Certains embryons sains pourraient ne pas survivre jusqu'au jour 5.
- La biopsie des embryons du jour 3 peut conduire à l’arrêt de l’embryon (l’embryon cesse de se développer).
- PGT-M/PGT-A n’est pas infaillible, et un enfant avec une maladie ou un trouble génétique peut encore en résulter. Le dépistage prénatal en plus du PGT-M/PFT-A est recommandé pour une assurance supplémentaire.
- Un bon dépistage préimplantatoire et prénatal ne garantit pas que l’enfant ne sera pas affecté par d’autres types de handicaps physiques ou mentaux.